药物分析与高效化科研团队
Pharmaceutical Analysis & Efficiency Research Team
一、团队概况
药物分析与高效化科研团队组建于2019年,由5名教授、6名副教授及多名青年讲师、研究生组成。主要从事纳米生物材料合成及其医学应用、代谢组学分析方法研究及应用、药物晶体工程与设计、药物传送与控释、以及功能化纳米复合材料的合成及其在药物分析领域中的应用等研究。
团队自成立以来,已完成国家级、省部级以及企业委托项目20余项,发表SCI论文100余篇,申请专利20余项,指导毕业研究生50余名。

二、研究方向
1.药物晶体工程与设计
目前,85%以上的药物为固体产品,其不同的固态特征(晶型、晶习、粒度与分布等)往往导致其理化性质如熔点、溶解度、稳定性、吸湿性、纯度等有所差异,而这些差异通常会影响药物在体内的溶出度、生物利用度和生物活性,进而在一定程度上影响药物的疗效和安全性。
药物产品的固态特征依赖于药物晶体的自组装过程,因此,利用化合物超分子相互作用和自组装机制来制备具有医药活性及特定晶体形态的药物,研究固体形态与药物疗效之间的关系,药物最优结晶工艺的确定及工程放大,制剂过程及最终产品的晶型控制,是制药工业的共性科学问题与关键技术。
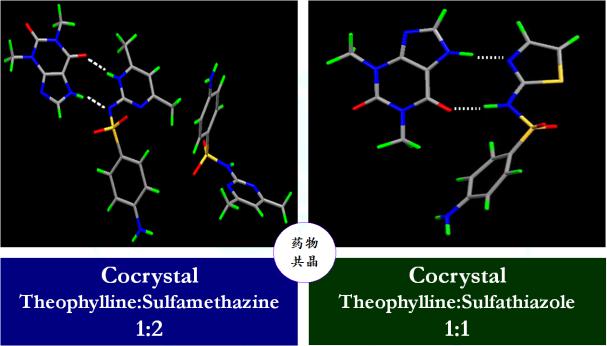
该研究方向集中于(1)药物晶体组装多样性机理;(2)药物多晶型(假多晶型)、盐、共晶等药物材料的发现、筛选与控制;(3)小分子与大分子药物高端化、高效化利用的新型结晶技术;(4)创新药物设计。
2.纳米生物材料的构建及其在医学中应用
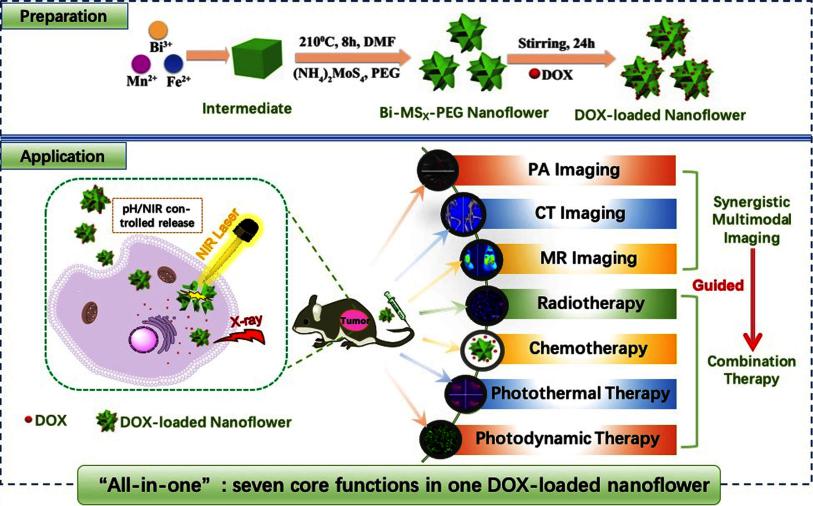
纳米生物材料由于其高效、低毒副作用,在生物医学诊断和治疗方面显示出巨大的优势,是目前化学、材料学、生物学和医学等学科交叉的研究热点。该方向主要研究多功能纳米诊疗材料的构建,包括二氧化硅、金属硫化物、金属氧化物、贵金属、聚合物等,探索其在药物靶向递送、荧光成像、核磁成像、CT成像、光热治疗、光动力学治疗、化学动力学治疗、化疗、放疗等医学方面的应用。
3.代谢组学分析方法研究和应用
该方向主要集中于:色谱−质谱联用技术的非靶向、靶向代谢组学和代谢流分析方法研究;肠道菌群−宿主代谢相互作用及在肥胖相关疾病的代谢机制研究等。
4.磁性功能材料
随着基因组学、蛋白质组学及生物医药技术的快速发展,具有特定环境响应能力的各种尺寸的功能微球在生物医学领域呈现了巨大的应用潜力。通过特定的结构设计及表面修饰,磁性复合微球可用于DNA、蛋白质及其它生物活性分子的快速分离及纯化、免疫诊断试剂、靶向药物载体、磁热治疗和磁共振成像试剂等。该方向以终端应用为牵引,在胶体性质及界面化学理论研究的指导下,按需制备各种结构的功能性磁性聚合物微球,用以满足环境污染物的去除、药物载体及各种生物分子分离的要求。

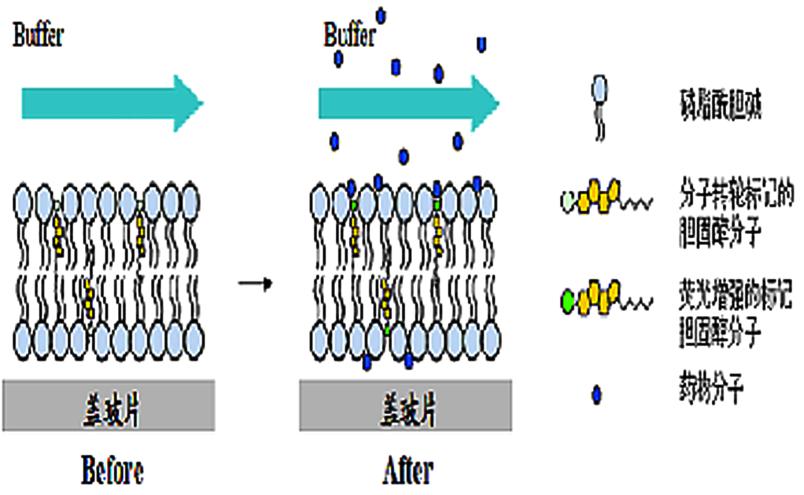
5.药物与脂质膜相互作用机制研究
开发无标记荧光检测技术以快速、有效检测药物与细胞膜的相互作用,实现药物与细胞膜相互作用的实时动态检测。
三、主要成员
陆杰教授,从事药物结晶、纳米晶体功能材料、选择性分离与智能化、药物控释与处方前等领域的研究。
张敏教授,从事功能化磁性纳米材料的制备及应用,应用领域包括蛋白分离与富集、有机污染物小分子检测及去除等。
刘锡建教授,从事纳米生物材料合成及其医学应用(药物传输、生物成像、光热治疗、化学动力学治疗等)方面的研究。
郑静教授,从事磁性纳米功能材料设计与合成、生物分子分离、疾病标志分子的检测等方面的研究。
张丽娟教授,从事新型分离材料及分离技术在药物制备中的应用研究。
四、代表论文
1. M. Zhang, X. Liu*, Q. Luo, Q. Wang, L. Zhao, G. Deng, R. Ge, L. Zhang*, J. Hu, and J. Lu*. Tumor environment responsive degradable CuS@mSiO2@MnO2/DOX for MRI guided synergistic chemo-photothermal therapy and chemodynamic therapy. Chem. Eng. J., 2020, 389, 124450.
2. X. Liu, J. Liu, J. Wang, T. Wang, Y. Jiang, J. Hu, Z. Liu*, X. Chen*, and J. Yu*. Bioinspired, microstructured silk fibroin adhesives for flexible skin sensors. ACS Appl. Mater. Interfaces, 2020, 12 (5), 5601-5609.
3. L. Ren, X. Liu*, T. Ji, G. Deng, F. Liu, H. Yuan, J. Yu, J. Hu, and J. Lu*. "All-in-one" theranostic agent with seven functions based on Bi-doped metal chalcogenide nanoflowers. ACS Appl. Mater. Interfaces, 2019, 11, 45467-45478.
4. Y. Wang, X. Liu*, G. Deng, J. Sun, H. Yuan, Q. Li, Q. Wang, and J. Lu*. Se@SiO2-FA-CuS nanocomposites for targeted delivery of DOX and nano selenium in synergistic combination of chemo-photothermal therapy. Nanoscale, 2018, 10, 2866-2875.
5. R. Zhang, N. Lu*, J.X. Zhang, R.H. Yan, J. Li, L.H. Wang, N. Wang, M. Lv*, M. Zhang* Ultrasensitive aptamer-based protein assays based on one-dimensional core-shell nanozymes. Biosens. Bioelectron., 2020, 150, 111881.
6. M. Zhang, J. Zheng*, J.P. Wang, J.L. Xu, T. Hayat, N.S. Alharbi. Direct electrochemistry of cytochrome C immobilized on one dimensional Au nanoparticles functionalized magnetic N-doped carbon nanotubes and its application for the detection of H2O2. Sens. Actuators B, 2019, 282, 85-95.
7. X. Xu, H. Feng*, L. Huang, X. Liu*. Direct amidation of carboxylic acids through an active α-acyl enol ester intermediate. J. Org. Chem., 2018, 83, 7962-7969.
8. L. Zhao, F. Hao , J. Huang, X. Liu, X. Ma, C. Wang, Y. Bao, L. Wang, W. Jia, A. Zhao, W. Jia. Sex- and age-related metabolic characteristics of serum free fatty acids in healthy chinese adults. J. Proteome Res., 2020, 19(4), 1383-1391.
9. L. Zhao, Y. Ni, M. Su, H. Li, F. Dong, W. Chen, R. Wei, L. Zhang, S.P. Guiraud, F.P. Martin, C. Rajani, G. Xie, W. Jia. High throughput and quantitative measurement of microbial metabolome by gas chromatography/mass spectrometry using automated alkyl chloroformate derivatization. Anal. Chem., 2017, 89(10), 5565-5577.
10. J. Zheng, M. Zhang*, X.H. Guo, J.P. Wang, J.L. Xu. Boronic acid functionalized magnetic composites with sandwich-like nanostructures as a novel matrix for PDGF detection. Sens. Actuators B, 2017, 250, 8-16.
